
Kaltplasmatherapie – innovation meets medicine
Die Zukunft der Wundbehandlung
Kaltes atmosphärisches Plasma inaktiviert auf unkomplizierte und schmerzlose Weise Viren, Bakterien (einschließlich multiresistenter Erreger) und Sporen. Auf diese Weise unterstützt eine Behandlung mit Kaltplasma die Reduktion von Antibiose. In Zeiten von multiresistenten Erregern bedeutet diese Therapiemöglichkeit einen Quantensprung in der Wundheilung. * 1,2,3,4,5,6,7,8,9
Die reaktiven Spezies im Kaltplasma aktivieren die Ausschüttung von Zytokinen-Proteinen, welche das Zellwachstum und die Differenzierung von Zellen regulieren. Für eine bessere Durchblutung des betroffenen Bereichs und der Wundumgebung regt Kaltplasma die Angiogenese, also die Gefäßbildung aus bereits vorhandenen Blutgefäßen, an. * 10
Der entscheidende Vorteil von Kaltplasma ist, dass es frei von Resistenzen, Allergenen und Nebenwirkungen ist und den Einsatz von belastenden Medikamenten stark reduzieren kann.
Quellverweise: siehe unten

Medizinprodukt
Die Viromed Medical AG lässt das ViroCAP europaweit als Medizinprodukt zu. Die Anwendungsbereiche, die sich aus der klinischen Bewertung ergeben, werden von unseren Anwälten für Medizinrecht finalisiert, damit jedes einzelne Wort geprüft ist.


Dieser Prozess wird von einem renommierten, akkreditierten Zertifizierungsdienstleister begleitet und durchgeführt. Eine Zertifizierung des Produkts als Medizinprodukt wird noch im Jahr 2025 erwartet.
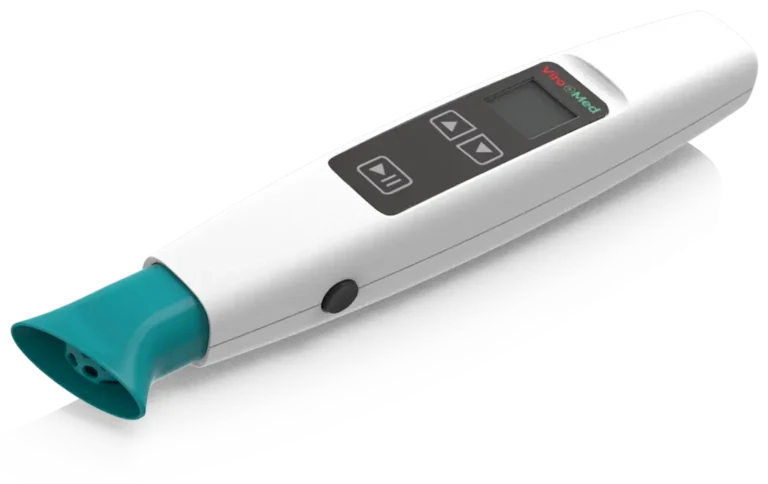
Einfacher Behandlungsablauf
Behandeln Sie effektiv, schmerzfrei und schnell
Reinigen Sie den zu behandelnden Bereich zuerst manuell. Entnehmen Sie dann das Handgerät aus der Ladeschale und bringen Sie einen sterilen Abstandhalter an. Durch einfachen Tastendruck können Sie die Anwendungsdauer auf 1 Minute oder 2 Minuten einstellen.
Halten Sie das ViroCAP mit dem Abstandhalter ca. 5 mm über der zu behandelnden Fläche und starten Sie per Knopfdruck die Anwendung.
Ein akustisches Signal zeigt Ihnen jeweils nach 30 Sekunden an, dass das Gerät weitergeführt werden kann. (Bei regulären Wunden ist eine Anwendungszeit pro Wundareal von 30 Sek. ausreichend. Bei infizierten Wunden können Sie die Anwendungszeit auf 1 Min. erhöhen.)
Ein Abstandhalter ist mit dem Start der ersten Anwendung für 20 Minuten aktiviert. Sie können also 20 Anwendungen je 1 Minute oder 10 Anwendungen je 2 Minuten am Patienten durchführen und somit auch größere Flächen problemlos behandeln.
Ein steril verpackter Abstandhalter aus biokompatiblem Kunststoff erfüllt alle Anforderungen für den Einsatz in Kliniken und Arztpraxen.
- Keine Strahlung, kein Strom auf der Haut
- Maximaltemperatur unter 40 °C
- Nur 1 bis 2 Minuten pro Anwendung
- Mobil einsetzbar und leicht zu bedienen
- Kein Kontakt mit der Haut erforderlich
(*) Quellangaben 1-10:
1 Arndt, S. et al. Effects of Cold Atmospheric Plasma (CAP) on ß-Defensins, Inflammatory Cytokines, and Apoptosis-Related Molecules in Keratinocytes in Vitro and in Vivo. PloS One 2015, 10 (3), e0120041. https://doi.org/10.1371/journal.pone.0120041.
2 Arndt, S. et al. Cold Atmospheric Plasma (CAP) Activates Angiogenesis-Related Molecules in Skin Keratinocytes, Fibroblasts and Endothelial Cells and Improves Wound Angiogenesis in an Autocrine and Paracrine Mode. J. Dermatol. Sci. 2018, 89 (2), 181–190. https://doi.org/10.1016/j.jdermsci.2017.11.008.
3 Arndt, S. et al. Cold Atmospheric Plasma (CAP) Changes Gene Expression of Key Molecules of the Wound Healing Machinery and Improves Wound Healing in Vitro and in Vivo. PloS One 2013, 8 (11), e79325. https://doi.org/10.1371/journal.pone.0079325.
4 Hasse, S. et al. Induction of Proliferation of Basal Epidermal Keratinocytes by Cold Atmospheric-Pressure Plasma. Clin. Exp. Dermatol. 2016, 41 (2), 202–209. https://doi.org/10.1111/ced.12735.
5 Nicol, M. J. et al. Antibacterial Effects of Low-Temperature Plasma Generated by Atmospheric-Pressure Plasma Jet Are Mediated by Reactive Oxygen Species. Sci. Rep. 2020, 10 (1), 3066. https://doi.org/10.1038/s41598-020-59652-6.
6 Hoon Park, J. et al. Comparative Study for the Inactivation of Multidrug Resistance Bacteria Using Dielectric Barrier Discharge and Nano-Second Pulsed Plasma. Sci. Rep. 2015, 5 (1), 13849. https://doi.org/10.1038/srep13849.
7 Zimmermann, J. et al. Test for Bacterial Resistance Build-up against Plasma Treatment. New J. Phys. 2012, 14 (7), 073037. https://doi.org/10.1088/1367-2630/14/7/073037.
8 Daeschlein, G. et al. Skin and Wound Decontamination of Multidrug-Resistant Bacteria by Cold Atmospheric Plasma Coagulation. J. Dtsch. Dermatol. Ges. J. Ger. Soc. Dermatol. JDDG 2015, 13 (2), 143–150. https://doi.org/10.1111/ddg.12559.
9 Bourke, P. et al. Microbiological Interactions with Cold Plasma. J. Appl. Microbiol. 2017, 123 (2), 308–324. https://doi.org/10.1111/jam.13429.
10 Weiss, Daeschlein, Kramer et. al. Virucide Properties of Cold Atmospheric Plasma for Future Clinical Applications, Journal of Medical Virology 2017, 89, 952-959.
Interesse geweckt?
Jetzt Anfragen!
Kontaktieren Sie uns unverbindlich für weitere Informationen.
